1. 물질 (물질의 분류, 상태, 성질, 용액)
1. 물질
(1) 물질의 분류
1) 혼합물-균일 혼합물, 불균일 혼합물, 재결정
2) 순물질-끓는점, 어는점, 배수비례의 법칙 (한 원소의 일정량과 결합하는 다른 원소의 질량비는 항상 정수비)
(2) 물질의 상태: 고체, 액체, 기체
1) 기체의 법칙
보일의 법칙 (온도가 일정할때, 부피는 압력에 반비례 PV=PV)
샤를의 법칙 (압력이 일정할때, 부피는 정대온도에 비례, V/T=V/T)
아보가드로의 법칙 (온도가 같다면 같은 부피에 같은 수의 분자가 있다.)
이상기체 방정식 (PV=nRT, R=0.082 L atm/k mol), 1 기압= 760 mmHg
돌턴의 부분 압력의 법칙
2) 기체분자의 확산속도
기체의 운동에너지 온도에 비례, 가벼운 입자의 속도가 빠르다., 그레이엄의 확산속도 법칙-공식
(3) 물질의 성질
1) 물리적/화학적 성질
2) 상변화 (에너지, 열의 흡수와 방출)
3) 열량 측정
비열-물질 1g을 1℃ 올리는데 필요한 열량, 열용량- 물질의 온도를 1℃ 올리는데 필요한 열량, 비열과 질량 곱한 값
(4) 용액
1) 정의 (용액, 용매, 용질)
2) 용액의 농도 (질량 백분율, 몰농도= 용질 mol/용액 L, 몰랄농도 = 용질 mol/ 용매 1kg
ppm (x 10 6)
3) 용해도 (용매 100g에 최대한으로 녹을 수 있는 용질의 g 수, g/L)
-이온화합물은 극성 용매에 잘 녹는다.
-몰 용해도 (mol/L)
-용해도 곱 (최대로 녹았을 경우, 양이온의 몰농도와 음이온의 몰농도의 곱, 평형상수 K ≒ 용해도 곱상수)
-해리도 a=
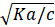
-온도, 압력 영향 받음
4) 용액의 종류 (포화/불포화 용액, 콜로이드 용액 =10-7~10-5 cm 용질의 입자, 소수 콜리이드=먹물, 친수 콜로이드 = 아교 녹말, 브라운 운동= 콜라이드 입자의 불규칙한 운동, 투석= 콜로이드 입자의 분리 정제, 묽은 용액의 총괄성-증기압 내림-순수한 용메에 비해 용액의 증기압은 낮아진다., 끓는점 오름, 어는점 내림- 몰랄농도에 비례-물질이 많으면 변화가 크다.)